全力推進基因療法,FDA發布6大新指南
近日,美國FDA局長Scott Gottlieb博士發表聲明,宣布FDA將繼續大力推進基因療法的開發,并發布了6大新指南。在今天的這篇文章中,將為各位讀者整理分享新指南的具體內容。
基因療法曾經只是一種理論,現在對于患者來說已經成為一種治療現實。基因療法具有治療和治愈一些難治性的疾病的潛力。FDA為基因產品如何開發、監管機構審核和報銷建立的政策框架,將有助于為這個新市場的持續發展奠定基礎。去年,我們發布了再生醫學框架草案,提到了加速開發的幾種途徑,例如突破性療法認定和再生醫學先進療法認定(RMAT),這些可能適用于基因療法的開發機構。今天,FDA為基因療法的開發、審查和批準推出一個補充框架。

▲2017年11月發布的再生醫學框架草案中,FDA提到將采取5種途徑加快再生醫學產品審批(圖片來源:FDA官網)
在過去的12個月中,FDA批準了三種基因療法產品。這反映了該領域的快速發展。我們達到了一個拐點,能夠可靠地將基因盒(gene cassettes)輸送到體內、細胞和人體中。未來,我們預計該領域將繼續向前發展,可能會有許多治療衰弱性疾病的基因療法獲批。這些療法有很大的希望。我們的新舉措旨在促進這一創新領域的發展。
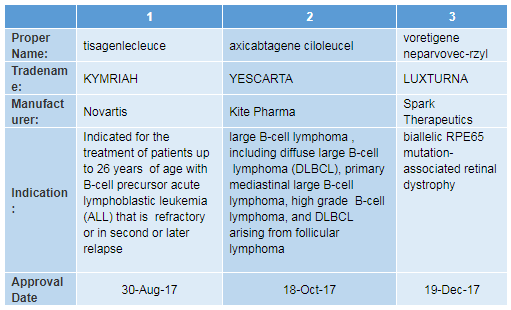
▲FDA批準的3種基因療法(信息來源:FDA官網)
基因療法正在針對許多疾病領域進行研究,包括遺傳疾病,自身免疫疾病,心臟病,癌癥和艾滋病。我們期待與學術界和研究界合作,為更多患者提供安全有效的產品。但我們知道,我們仍然需要了解基因產品的工作原理,如何安全地使用它們,以及它們是否能夠在體內繼續正常工作而不會產生長期副作用。與傳統的藥物審查相比,基因治療更具挑戰性的問題是產品制造和質量,或者是反應持久性,這在任何合理規模的上市前試驗中往往無法完全回答。在批準一些基因產品時,我們可能需要接受這些問題在某種程度上的不確定性。例如,在某些情況下,在批準時還不知道是否長期有效。進行可靠的上市后跟蹤的有效工具,例如所需的上市后臨床試驗,將成為推動基因治療領域發展的關鍵,并幫助確保能夠帶來安全和創新的療法。
即使可能存在不確定性,我們也需要確保患者安全,并充分描述基因產品的潛在風險并證明其有益。基因產品最初的目的是治療毀滅性疾病,其中許多缺乏治療方法,包括一些致命性疾病。在沒有可用療法的情況下,FDA歷來愿意接受更多的不確定性,以便及時獲得有希望的療法。在這種情況下,藥物申辦方通常需要進行上市后臨床試驗,稱為4期臨床試驗,以確認藥物的臨床益處。這是國會給予FDA的權力,例如實施加速批準這樣的路徑。
當涉及基因治療等新技術時,FDA將與時俱進,以確保適應這些新技術平臺所帶來的獨特挑戰。今天,我們正在朝著塑造現代基因療法監管結構方面邁出一步。FDA計劃發布一套六個科學指導文件,作為全面監管框架的基石,幫助我們推進基因治療領域,同時確保新產品符合FDA的安全性和有效性黃金標準。
3個特定疾病基因治療指南
今天,我們發布了三份針對特定疾病的基因治療產品開發的新指南。這是FDA為基因治療產品發布的前三種特定疾病指南。
血友病的人類基因治療:目前正在開發的血友病基因治療產品作為單次治療,可以使患者長期生成體內缺失或異常的凝血因子,減少或消除對凝血因子替代品的需要。為了確定這些產品的正確開發途徑,FDA發布了一份《治療血友病的基因療法產品的新指南草案(draft guidance on gene therapy products that are targeted to the treatment of hemophilia)》。一旦最終確定,這一新指南將提供關于臨床試驗設計和臨床前考慮因素的建議,以支持這些基因治療產品的開發。除其他要素外,指南草案還提供了關于替代終點的建議,供加速批準用于治療血友病的基因治療產品使用。
視網膜疾病的人類基因治療:另一個熱門領域是治療視網膜疾病的基因治療產品。FDA也計劃發布《視網膜疾病的人類基因療法指南( Human Gene Therapy for Retinal Disorders guidance)》。目前在美國進行視網膜疾病臨床試驗的基因治療產品通常是玻璃體內注射或視網膜下注射。在一些情況下,基因治療產品被封裝在要植入眼內的裝置中。這份新的指南將重點關注視網膜疾病基因治療的特殊問題,提供了產品開發、臨床前測試和臨床試驗設計相關的建議。
罕見疾病的人類基因治療:在美國,患病人數少于20萬人的疾病被稱為罕見病。美國國立衛生研究院報告說,總共近7000種罕見病影響了超過2500萬美國人。大約80%的罕見病是由單基因缺陷引起的,大約一半的罕見病都會影響兒童。由于大多數罕見病沒有批準的治療方法,因此存在顯著的未滿足需求。《罕見病的人類基因療法指南(Human Gene Therapy for Rare Diseases guidance)》一旦最終確定,將提供關于臨床前、制造和臨床試驗設計的建議。該信息旨在幫助申辦者設計臨床開發計劃,其中可能存在有限的研究人群規模潛在的可行性和安全性問題,以及與解釋有效性的問題。
3個基因療法制造的指南更新
今天,我們還提供了三個現有指南的全面更新,解決了與基因治療相關的制造問題。
第一份指南,《人類基因治療研究新藥申請(INDs)的化學,制造和控制(CMC)信息》,關于申辦方如何提供足夠的CMC信息以確保在研基因治療產品的安全性、均一性、質量、純度和效力的建議。該指南適用于人類基因療法,以及含有人類基因療法的產品與藥物或裝置組合使用。
第二份指南,《在產品制造和患者隨訪期間,測試逆轉錄病毒載體基因治療產品具有復制能力的逆轉錄病毒》提供了在制造基于逆轉錄病毒載體的基因治療產品期間,以及在接受基于逆轉錄病毒載體的基因治療產品的患者的隨訪監測期間,正確測試RCR的更多建議。具體而言,指南建議確定需要測試的材料和數量。該指南還就一般測試方法提供了建議。
第三份指南,《人類基因治療產品給藥后的長期隨訪》提供有關設計長期隨訪(LTFU)觀察性研究的建議,以便收集基因治療產品給藥后延遲不良事件的數據。由于基因療法這樣的新技術平臺所固有的一些額外不確定性——包括與治療效果持久性有關的問題,以及基因如果插入不正確,在理論上可能產生脫靶效應——因此,需要在上市后對患者進行重點的長期隨訪。本指南描述了產品特征、患者相關因素、臨床前和臨床數據,這些數據在評估長期隨訪的必要性時應予以考慮,指南還說明了有效的上市后跟蹤的特點。
一旦最終確定,這些草案指南將取代FDA在2008年4月(CMC)和2006年11月(RCR和LTFU)發布的更早版本的指南。
基因療法有望為許多難治性疾病帶來高效甚至治愈的希望。其中一些基因產品幾乎肯定會改變醫療實踐的范式,以及患有某些疾病患者的命運。
FDA的目標是幫助這些創新療法在確保安全性和有效性的框架內發展,并繼續建立人們對這一新興醫學領域的信心。
上一篇:下一篇:
- 2018.11.28
- 這樣的劇情只有科幻片才敢拍,卻在中國真實上演
相信你也看到了今天的新聞:世界首例基因編輯嬰兒,在中國誕生。新聞一經傳出,就引發網友、科學...
- Read More
-

- 2018.08.16
- 為什么人類大腦與眾不同?答案在ASPM基因
通過使一個與人類小頭畸形相關的基因失活,研究人員得到第一只神經系統變異的雪貂。霍華德休斯醫...
- Read More
-